O que é pH?
Você certamente já estudou sobre pH nas aulas de bioquímica da faculdade. Mas você sabe a definição desse conceito ou consegue explicar com suas palavras o que ele significa? Muitos alunos têm dificuldade, e é por isso que hoje você vai entender de uma vez por todas essa definição.
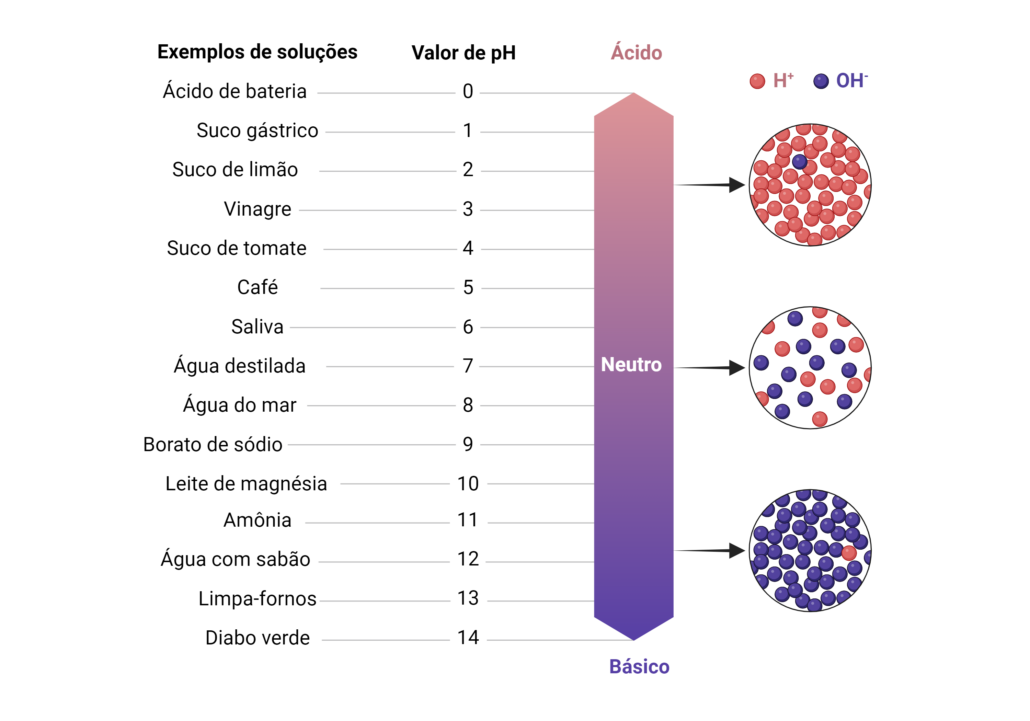
Em suma, pH nada mais é do que uma medida que quantifica a acidez ou basicidade de uma solução aquosa, ou seja, o quanto a solução é ácida ou básica. Derivado do termo latino “potentia hydrogenii”, que significa “potencial de hidrogênio”, esse potencial é calculado como o logaritmo negativo da concentração de íons hidrogênio em uma solução. A escala varia de 0 a 14, onde valores menores que 7 indicam uma solução ácida, valores maiores que 7 indicam uma solução básica (alcalina) e um valor de 7 representa uma solução neutra.
Conceito de pH
A fórmula matemática que define o pH é:
pH= −log[H+]
Aqui, [H+] representa a concentração molar de íons hidrogênio na solução. Em uma solução neutra, como a água pura, a concentração de íons H+ é 1 x 10^-7 moles por litro, resultando em um valor de 7. Em soluções ácidas, a concentração de íons H+ é maior, enquanto em soluções básicas é menor.
Importância do pH
Biologia e saúde: Em fluidos corporais, como sangue e saliva, o pH é rigorosamente regulado, pois desvios significativos podem ser prejudiciais. Por exemplo, no sangue, o valor normal varia entre 7,35 e 7,45. Alterações significativas podem levar a condições como acidose ou alcalose, que podem ser fatais.
Agricultura: No solo, ele influencia a disponibilidade de nutrientes para as plantas. Solos muito ácidos ou muito alcalinos podem ser inadequados para o crescimento de determinadas culturas. Agricultores frequentemente ajustam o pH do solo usando cal (para aumentar) ou enxofre (para diminuir).
Indústria alimentícia: O pH é vital no processamento e conservação de alimentos. Por exemplo, valores baixos em conservas impede o crescimento de bactérias patogênicas. A fermentação de produtos como iogurte e queijo também dependem também desse controle para obter a textura e o sabor desejados.
Tratamento de água: No tratamento de água potável e efluentes, o pH é monitorado e ajustado para garantir que a água seja segura para consumo humano e que os processos de purificação sejam eficazes.
Medição do pH
Existem diversas técnicas, desde métodos simples até instrumentação sofisticada:
- Indicadores de pH: São substâncias que mudam de cor dependendo do pH da solução. Exemplos incluem o azul de bromotimol e a fenolftaleína. Embora simples e baratos, os indicadores oferecem uma precisão limitada.
- Papéis de Tornassol: São tiras de papel impregnadas com indicadores. Quando mergulhadas na solução, mudam de cor conforme o pH, permitindo uma estimativa rápida e fácil.
- pHmetros: São dispositivos eletrônicos que medem o pH com alta precisão. Utilizam um eletrodo de vidro sensível a íons H+, fornecendo uma leitura digital exata.
Aplicações avançadas
Em laboratórios de pesquisa, esse parâmetro é essencial para muitas reações químicas e bioquímicas. A atividade enzimática, por exemplo, é altamente dependente do pH, com cada enzima tendo um valor ótimo no qual sua atividade é máxima. Em bioquímica, a regulação desse potencial é crucial para estudos de cinética enzimática e estrutura de macromoléculas.
Gostou? Conheça nossos treinamentos:
Curso de coleta
Plataforma cursau (com mais de 800H de conteúdo e grupo vip)
Pós graduações: micro, análises e perícia
Referência bibliográfica:
NELSON, David L.; HOSKINS, Aaron A.; Cox, Michael M.. Princípios de Bioquímica de Lehninger. 8. ed Porto Alegre: Artmed, 2022, 1220.