CRISPR-Cas9
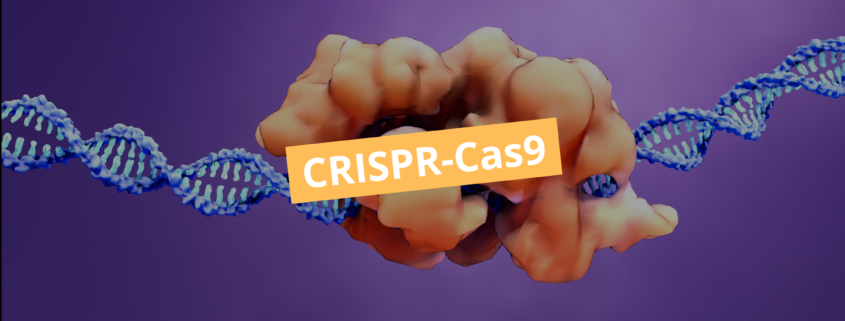
A tecnologia CRISPR-Cas9 emergiu como uma ferramenta revolucionária na biologia molecular, permitindo a edição precisa do genoma com uma eficiência sem precedentes. Derivada de um mecanismo natural de defesa bacteriana contra vírus, essa técnica possibilita alterações direcionadas em sequências genéticas, promovendo avanços significativos em genética funcional, terapia gênica, biotecnologia e pesquisa biomolecular.
Origens e descobertas históricas
O sistema CRISPR-Cas foi inicialmente identificado em bactérias e arqueias na década de 1980, quando sequências repetitivas curtas no DNA bacteriano foram descritas por Ishino et al. (1987). O significado funcional dessas sequências permaneceu obscuro até o início dos anos 2000, quando estudos revelaram que essas regiões funcionavam como memórias genéticas contra bacteriófagos, armazenando fragmentos de DNA viral para reconhecimento futuro.
Em 2012, Jennifer Doudna e Emmanuelle Charpentier demonstraram que o CRISPR-Cas9 poderia ser adaptado para edição de genes em células eucarióticas, abrindo caminho para aplicações experimentais em organismos multicelulares. Esse trabalho rendeu o Prêmio Nobel de Química em 2020, consolidando o CRISPR-Cas9 como uma tecnologia central da biologia molecular moderna.
Mecanismo de ação molecular
O sistema CRISPR-Cas9 combina um RNA guia (gRNA) com a nucleasse Cas9 para introduzir cortes específicos em regiões alvo do DNA.
- Reconhecimento do alvo: o gRNA emparelha-se com a sequência complementar no DNA, adjacente a um motivo PAM (Protospacer Adjacent Motif), essencial para a atividade da Cas9.
- Clivagem do DNA: Cas9 realiza um corte duplo na fita de DNA, gerando uma quebra de dupla hélice.
- Reparo e edição: os mecanismos celulares reparam a quebra por reparo por união de extremidades não homólogas (NHEJ) ou reparo homólogo dirigido (HDR), permitindo a inserção, deleção ou substituição de nucleotídeos.
Aplicações científicas detalhadas
Desde 2012, o CRISPR-Cas9 tem sido aplicado em diversas áreas da pesquisa:
- Genética funcional: criação de knockouts ou knock-ins de genes para análise fenotípica em células e organismos modelo.
- Modelos animais: camundongos, zebrafish e outros organismos geneticamente modificados permitem o estudo de doenças complexas.
- Terapia gênica experimental: correção de mutações causadoras de doenças hereditárias em modelos celulares e pré-clínicos.
- Biotecnologia: modificação de microrganismos para produção de enzimas, biofármacos ou compostos industriais.
- Agronomia e melhoramento genético: desenvolvimento de plantas resistentes a estresses bióticos e abióticos ou com características nutricionais aprimoradas.
- Edição epigenética e transcriptômica: versões “mortas” da Cas9 (dCas9) permitem ativar ou silenciar genes sem cortar o DNA, ampliando a regulação de expressão gênica em pesquisas funcionais.
Exemplos recentes incluem a edição de células T para imunoterapias contra câncer e a modificação de células hematopoiéticas para corrigir mutações causadoras de doenças sanguíneas.
Variações e técnicas derivadas do CRISPR
O CRISPR-Cas9 evoluiu rapidamente, dando origem a diversas variantes:
- Cas12 e Cas13: permitem edição de DNA e RNA, respectivamente, expandindo o alcance da tecnologia.
- Base editors: promovem substituições de nucleotídeos sem cortar a dupla hélice.
- Prime editing: combina Cas9 nickase com transcriptase reversa para alterações precisas e mínimas no genoma.
Essas variantes oferecem maior precisão e menos efeitos fora do alvo, ampliando a aplicabilidade do CRISPR em contextos experimentais e terapêuticos.
Limitações e desafios
Apesar do potencial revolucionário, a técnica apresenta limitações técnicas e éticas:
- Off-target effects: cortes não intencionais podem gerar mutações indesejadas.
- Eficiência variável: certos loci genômicos ou tipos celulares apresentam baixa receptividade à edição.
- Barreiras técnicas: entrega eficiente do sistema CRISPR em células específicas ainda é um desafio em terapias clínicas.
- Questões éticas e regulatórias: especialmente em edição germinativa, que poderia gerar alterações hereditárias em humanos.
Pesquisas em estratégias de minimização de off-target e métodos de entrega seguras são essenciais para a aplicação clínica futura.
Perspectivas futuras
O CRISPR-Cas9 está consolidado como uma das ferramentas centrais da biologia molecular moderna, com potencial para:
- Medicina experimental: terapias personalizadas e correção de mutações antes do desenvolvimento da doença.
- Biotecnologia industrial: organismos geneticamente modificados para produção de biofármacos e biocombustíveis.
- Pesquisa evolutiva e funcional: análise de redes gênicas e compreensão de mecanismos moleculares complexos.
Com o desenvolvimento contínuo de novas nucleases, base editors e prime editors, espera-se que o CRISPR se torne ainda mais preciso, eficiente e seguro, ampliando sua aplicação em ciência e tecnologia.
Se você quer praticar conceitos como CRISPR-Cas9, revisar técnicas de laboratório e testar seu conhecimento, o Cursau HUB oferece conteúdos interativos, resumos práticos e exercícios para dominar a biologia molecular de forma rápida e aplicada.