Entenda a cadeia transportadora de elétrons
A cadeia transportadora de elétrons é um componente essencial do metabolismo energético celular, desempenhando um papel fundamental na produção de energia em organismos aeróbicos. Localizada na membrana interna das mitocôndrias nas células eucarióticas, ou na membrana plasmática em organismos procarióticos, a cadeia transportadora é o estágio final da respiração celular, onde a energia armazenada nas moléculas reduzidas NADH e FADH₂ é utilizada para gerar ATP, a principal moeda energética da célula.
A energia química dos alimentos é capturada através de processos como a glicólise, o ciclo do ácido cítrico e a beta-oxidação, onde as moléculas orgânicas são oxidadas e os elétrons são transferidos para os transportadores NAD⁺ e FAD. Esses transportadores reduzidos, NADH e FADH₂, levam os elétrons de alta energia para a cadeia transportadora, onde ocorre uma série de reações que exploraremos ao longo deste texto.
Além de sua importância na produção de ATP, a cadeia transportadora de elétrons também desempenha papéis fisiológicos adicionais, como a produção de espécies reativas de oxigênio (ERO), que têm funções regulatórias em baixos níveis, mas podem ser prejudiciais em concentrações elevadas, levando a estresse oxidativo e dano celular. Portanto, seu funcionamento eficiente e equilibrado é vital para a saúde celular e o metabolismo energético geral.
Estrutura e componentes da cadeia transportadora de elétrons
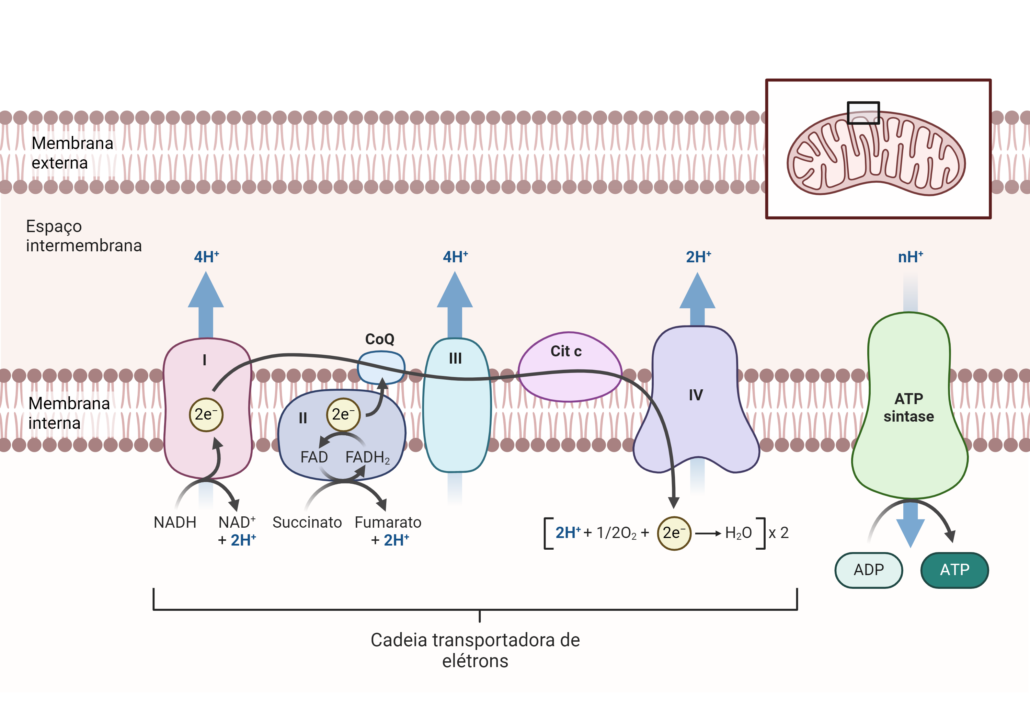
Em suma, a cadeia transportadora é composta por um conjunto de complexos proteicos e moléculas transportadoras de elétrons, organizados sequencialmente na membrana interna da mitocôndria em células eucarióticas. Essa disposição permite que os elétrons fluam de moléculas com maior energia livre para outras com energia livre menor, liberando energia em etapas controladas.
Complexo I (NADH: ubiquinona oxidoredutase)
O Complexo I é o maior dos complexos proteicos, formado por mais de 40 subunidades. Ele possui uma estrutura em formato de “L”, com um braço hidrofílico que se projeta para a matriz mitocondrial e um braço transmembrana inserido na membrana interna. O domínio hidrofílico contém cofatores como FMN (flavina mononucleotídeo) e clusters ferro-enxofre (Fe-S), organizados a fim de facilitar a transferência de elétrons. Além disso, o braço transmembrana possui canais que participam do movimento de prótons.
Complexo II (succinato: ubiquinona oxidoredutase)
O Complexo II é relativamente menor e contém quatro subunidades principais. Nesse sentido, inclui uma subunidade flavoproteica com FAD (flavina adenina dinucleotídeo) e outras subunidades que abrigam clusters Fe-S. Diferente do Complexo I, ele não possui estrutura para o bombeamento de prótons. Com isso, este complexo está ancorado à membrana interna por subunidades hidrofóbicas.
Ubiquinona (Coenzima Q)
A ubiquinona é uma molécula lipossolúvel de pequena dimensão, composta por uma cabeça quinona e uma longa cauda isoprenóide. Essa estrutura permite que ela se mova lateralmente dentro da bicamada lipídica, funcionando como um transportador móvel entre os complexos.
Complexo III (citocromo bc₁)
O Complexo III é composto por múltiplas subunidades, incluindo citocromos b e c₁ e um centro Fe-S. Em síntese, a organização estrutural do citocromo b inclui dois grupos heme, chamados b₅₆₆ e b₅₆₀, embutidos na membrana. O citocromo c₁, ligado ao espaço intermembrana, facilita então a transferência para o citocromo c. A estrutura tridimensional do complexo possibilita o ciclo Q, essencial para o transporte de elétrons.
Citocromo c
O citocromo c é uma proteína globular pequena, solúvel em água, que contém um grupo heme ligado covalentemente à proteína. Sua estrutura compacta permite uma alta mobilidade e especificidade na transferência de elétrons entre o Complexo III e o Complexo IV.
Complexo IV (citocromo c oxidase)
Por fim, temos o Complexo IV, uma estrutura grande composta por mais de 10 subunidades, com três principais: I, II e III. A subunidade I contém centros redox como CuA, CuB e grupos heme a e a₃, que facilitam a redução do oxigênio molecular a água. Sua estrutura transmembrana inclui canais para o bombeamento de prótons.
Mecanismo de transporte de elétrons
O transporte de elétrons ao longo da cadeia transportadora é um processo sequencial e altamente organizado, baseado em reações de oxidação-redução (redox). Os elétrons são transferidos de moléculas com potencial redox mais negativo para aquelas com potencial mais positivo, garantindo que a energia seja liberada de forma gradativa e controlada.
Entrada de elétrons no Complexo I
Os elétrons derivados do NADH entram no Complexo I, onde o NADH é oxidado a NAD⁺, liberando dois elétrons. Esses elétrons passam pelo flavina mononucleotídeo (FMN) e, posteriormente, pelos centros ferro-enxofre (Fe-S), antes de serem transferidos para a ubiquinona (Coenzima Q), que é reduzida a ubiquinol (QH₂). Nesse processo, parte da energia liberada é usada para bombear prótons para o espaço intermembrana.
Entrada de elétrons no Complexo II
Os elétrons provenientes do FADH₂ entram no Complexo II, onde o FADH₂ é oxidado a FAD. Esses elétrons também passam pelos centros Fe-S e são transferidos para a ubiquinona, formando ubiquinol. No entanto, ao contrário do Complexo I, o Complexo II não contribui para o bombeamento de prótons, já que a energia liberada aqui é insuficiente para essa função.
Ubiquinona como transportador móvel
A ubiquinona, sendo lipossolúvel, transporta os elétrons do Complexo I ou II até o Complexo III, movimentando-se lateralmente pela membrana mitocondrial interna. Esse transporte é eficiente graças à sua mobilidade na bicamada lipídica.
Complexo III e o ciclo Q
No Complexo III, os elétrons da ubiquinol são transferidos para o citocromo c através de uma série de intermediários, incluindo centros Fe-S e citocromos b e c₁. Esse processo é conhecido como ciclo Q, que permite a transferência sequencial de dois elétrons e contribui para o bombeamento adicional de prótons para o espaço intermembrana.
Citocromo c como transportador móvel
O citocromo recebe os elétrons do Complexo III e os entrega ao Complexo IV. Ele se move livremente na superfície da membrana interna, permitindo um transporte eficiente.
Transferência final no Complexo IV
No Complexo IV, os elétrons são transferidos do citocromo c para o oxigênio molecular (O₂), que atua como o aceitador final de elétrons. O oxigênio é reduzido, em conjunto com prótons, para formar água (H₂O). Esse passo final é vital para o funcionamento contínuo da cadeia e também contribui para o bombeamento de prótons.
Fosforilação oxidativa e síntese de ATP
A fosforilação oxidativa é o processo final da respiração celular, no qual a energia armazenada no gradiente de prótons criado pela cadeia transportadora de elétrons é utilizada para sintetizar ATP. Este processo ocorre na membrana interna da mitocôndria, sendo mediado pela ATP sintase, uma enzima altamente especializada que converte energia eletroquímica em energia química.
Formação do gradiente de prótons
Durante o transporte de elétrons pela cadeia, os Complexos I, III e IV utilizam a energia liberada pelas reações redox para bombear prótons (H⁺) da matriz mitocondrial para o espaço intermembrana. Esse bombeamento cria portanto um gradiente de concentração e uma diferença de carga elétrica (potencial eletroquímico) entre os dois compartimentos. Em resumo, essa força próton-motriz é a principal fonte de energia para a síntese de ATP.
O gradiente de prótons possui duas componentes:
- Diferença de concentração de prótons (gradiente químico): maior concentração de H⁺ no espaço intermembrana do que na matriz.
- Diferença de carga elétrica (gradiente elétrico): o lado do espaço intermembrana é mais positivo do que o lado da matriz.
Estrutura e função da ATP sintase
A ATP sintase é uma enzima complexa localizada na membrana mitocondrial interna, composta por duas subunidades principais:
- F₀ (componente transmembrana): atua como um canal para o retorno dos prótons ao interior da matriz mitocondrial.
- F₁ (componente catalítica): localizada na matriz, realiza a síntese de ATP a partir de ADP e fosfato inorgânico (Pi).
O funcionamento da ATP sintase ocorre em várias etapas:
- Os prótons retornam à matriz mitocondrial através do canal F₀, devido ao gradiente de concentração. Esse fluxo é chamado de quimiosmose.
- A passagem dos prótons faz com que a subunidade F₀ gire, transmitindo movimento rotacional à subunidade F₁.
- A energia mecânica gerada pela rotação induz mudanças conformacionais na F₁, que permitem a ligação do ADP ao Pi e a formação de ATP.
Eficiência da síntese de ATP
Cada molécula de NADH que doa elétrons à CTE resulta na produção de aproximadamente 2,5 moléculas de ATP. O FADH₂, por entrar na cadeia no Complexo II (que não bombeia prótons), gera cerca de 1,5 molécula de ATP por molécula oxidada. Assim, o rendimento total da respiração celular é altamente dependente do funcionamento eficiente da CTE e da fosforilação oxidativa.
Controle da fosforilação oxidativa
A fosforilação oxidativa é regulada principalmente pela disponibilidade de ADP e Pi, pois a síntese de ATP só ocorre se o gradiente de prótons for dissipada pela ATP sintase. Além disso, inibidores específicos, como o oligomicina (que bloqueia o canal F₀), ou desacopladores, como o 2,4-dinitrofenol (DNP), podem interferir nesse processo, reduzindo a eficiência da produção de ATP e gerando calor como subproduto.
Com a síntese de ATP concluída, a energia liberada pelo metabolismo celular é armazenada de forma que possa ser utilizada para processos celulares essenciais.
Importância biológica da cadeia transportadora
A cadeia transportadora de elétrons desempenha um papel central no metabolismo energético, sendo crucial para a manutenção da vida em organismos aeróbicos. Sua principal função é gerar ATP, a principal moeda energética da célula, mas suas implicações fisiológicas vão muito além disso, englobando processos regulatórios, adaptação celular e sinalização.
Produção de energia celular
O aspecto mais evidente da cadeia a produção de ATP, essencial para sustentar funções celulares como:
- Transporte ativo de íons e moléculas: processos como o funcionamento das bombas de sódio e potássio, vitais para o equilíbrio osmótico e a condução nervosa.
- Contração muscular: o ATP é indispensável para o ciclo de contração e relaxamento das fibras musculares.
- Biossíntese de macromoléculas: formação de proteínas, lipídios e ácidos nucleicos requer grandes quantidades de energia.
- Manutenção da homeostase celular: incluindo a replicação do DNA, reparo celular e remoção de substâncias tóxicas.
Papel na sinalização celular
A cadeia transportadora também regula importantes vias de sinalização celular:
- Produção de espécies reativas de oxigênio (ERO): Em condições fisiológicas por exemplo, baixos níveis de ERO gerados pela cadeia atuam como mensageiros secundários em processos como a proliferação celular e a resposta ao estresse. Contudo, a disfunção da CTE pode levar à produção excessiva de ERO, contribuindo para o estresse oxidativo e doenças relacionadas ao envelhecimento, como Alzheimer e Parkinson.
- Sensores metabólicos: A eficiência da cadeia e os níveis de ATP/ADP fornecem informações sobre o estado energético da célula, ativando vias como AMPK para ajustar o metabolismo celular.
Adaptação e flexibilidade metabólica
A cadeia transportadora permite que as células ajustem a produção de energia conforme as demandas. Em situações de privação de oxigênio, a célula redireciona sua atividade para vias anaeróbicas, como a glicólise. Por outro lado, em organismos multicelulares, diferentes tecidos podem priorizar o uso de NADH ou FADH₂, dependendo de suas necessidades energéticas específicas.
Disfunção da cadeia transportadora e implicações patológicas
O funcionamento inadequado da cadeia transportadora de elétrons está associado a diversas condições patológicas:
- Doenças mitocondriais: Mutações em genes que codificam proteínas da cadeia resultam em deficiência energética, afetando portanto tecidos com alta demanda de energia, como cérebro, coração e músculos.
- Estresse oxidativo crônico: Inegavelmente, a produção descontrolada de ERO pode levar a danos no DNA, lipídios e proteínas, contribuindo para doenças como câncer, aterosclerose e diabetes.
- Isquemia e reperfusão: Por fim, durante períodos de isquemia (baixa oxigenação), a cadeia acumula intermediários redox que, quando o oxigênio é reintroduzido, resultam na produção de grandes quantidades de ERO, agravando o dano tecidual.
Gostou? Conheça nossos treinamentos:
Curso de coleta
Plataforma cursau (com mais de 800H de conteúdo e grupo vip)
Pós graduações: micro, análises e perícia
Referência bibliográfica:
NELSON, David L.; COX, Michael M.. Princípios de bioquímica de Lehninger. 7 Porto Alegre: Artmed, 2019, 1278 p.